Окиснення
Відновлення
Окисно-відновна реакція між воднем та фтором
Поділяється на дві напівреакції:
1) Окиснення:
2) Відновлення:
Атоми та йони, які в даній реакції приєднують електрони є окисниками, а які віддають електрони — відновниками.
1.
Позначте формули
сполук, у яких ступені окиснення елементів дорівнюють нулю
1.
CO
2.
Cl2
3.
Zn
4.
SO2
5.
Li
6.
H2 SO4
2.
Позначте сполуки, в
яких Сульфур виявляє ступінь окиснення +4
1.
SO3
2.
SO2
3.
H2S
4.
H2SO3
5.
H2SO4
3.
Позначте рівняння
окисно-відновних реакцій
1.
C + O2 CO2
CO2
2.
NaOH +HCl  NaCl + H2O
NaCl + H2O
3.
Zn + CuCl2  Cu + ZnCl2
Cu + ZnCl2
4.
CaO + CO2  CaCO3
CaCO3
5.
2K + 2H2O  2KOH + H2
2KOH + H2
4.
Позначте записи процесів окиснення
1.
Fe+3 + 1e  Fe+2
Fe+2
2.
Fe0 -
2e  Fe+2
Fe+2
3.
Fe0 -
3e  Fe+3
Fe+3
4.
Fe+2 -
1e  Fe+3
Fe+3
5.
Fe+2 +
2e  Fe0
Fe0
5.
Позначте записи процесів , в яких Манган є відновником
1.
Mn0 - 2e  Mn+2
Mn+2
2.
Mn+4 + 2e  Mn+2
Mn+2
3.
Mn+4 + 1e  Mn+3
Mn+3
4.
Mn+3 -
1e  Mn+4
Mn+4
5.
Mn+6 -
1e  Mn+7
Mn+7
6.
Позначте правильні
твердження
1.
Окиснення завжди
супроводжується відновленням.
2.
Метод електронного
балансу ґрунтується на порівнянні ступенів окиснення атомів у реагентах і
продуктах реакції.
3.
Процес приєднання
електронів називають окисненням.
4.
Відновники під час
хімічної реакції віддають електрони.

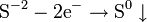










Немає коментарів:
Дописати коментар